
Cálculo de la energía libre de Gibbs
Los cambios en la energía libre
- Contenido de calor; T es la temperatura y S es la entropía del sistema. Fue desarrollada en los años 1870 por el físico-matemático estadounidense Williard Gibbs.
Cambios de energía libre estándar
La energía libre de reacción, se denota, 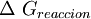 , es el cambio de energía en una reacción a condiciones estandares. En esta reacción los reactivos en su estado estandar se convierten en productos en su estado estandar
, es el cambio de energía en una reacción a condiciones estandares. En esta reacción los reactivos en su estado estandar se convierten en productos en su estado estandar
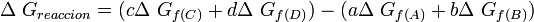
Donde A y B son los reactivos en estado estandar y; C y D son los productos en su estado estandar. Además a, b, c y d son sus respectivos coeficientes estequiométricos.
en general: 
donde m y n son los coeficientes estequiométricos.
Así como en en el cálculo de la entalpía, en la energía libre estándar de formación para cualquier elemento en su forma estable (1 atm y 25ºC) es 0

No hay comentarios:
Publicar un comentario