Entalpía química
Para una reacción exotérmica a presión constante, la variación de entalpía del sistema es igual a la energía liberada en la reacción, incluyendo la energía conservada por el sistema y la que se pierde a través de la expansión contra el entorno.(Es decir que cuando la reacción es exotérmica la entalpía del sistema es negativa). Análogamente, para una reacción endotérmica, la variación de entalpía del sistema es igual a la energía absorbida durante la reacción, incluyendo la energía perdida por el sistema y la ganada a través de la expansión contra el entorno.(En las reacciones endotérmicas el cambio de entalpía es positivo para el sistema, porque gana calor)
La entalpía total de un sistema no puede ser medida directamente; la variación de entalpía de un sistema sí puede ser medida en cambio.
La variación de entalpía se define mediante la siguiente ecuación:
- ΔH es la variación de entalpía.
- Hfinal es la entalpía final del sistema. En una reacción química, Hfinal es la entalpía de los productos.
- Hinicial es la entalpía inicial del sistema. En una reacción química, Hinicial es la entalpía de los reactivos.
La mayor utilidad de la entalpía se obtiene para analizar reacciones que incrementan el volumen del sistema cuando la presión se mantiene constante por contacto con el entorno, provocando que se realice un trabajo mecánico sobre el entorno y una pérdida de energía. E inversamente en reacciones que causan una reducción en el volumen debido a que el entorno realiza un trabajo sobre el sistema y se produce un incremento en la energía interna del sistema.
En este caso, la variación de entalpía se puede expresar del siguiente modo:
- DH = DU + P DV
Donde D puede indicar una variación infinitesimal (a menudo denotada como "d") o una diferencia finita (a menudo denotada como "Δ").
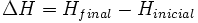
No hay comentarios:
Publicar un comentario