Entropía y reversibilidad
La entropía global del sistema es la entropía del sistema considerado más la entropía de los alrededores. También se puede decir que la variación de entropía del universo, para un proceso dado, es igual a su variación en el sistema más la de los alrededores:
Si se trata de un proceso reversible, ΔS (universo) es cero pues el calor que el sistema absorbe o desprende es igual al trabajo realizado. Pero esto es una situación ideal, ya que para que esto ocurra los procesos han de ser extraordinariamente lentos y esta circunstancia no se da en la naturaleza. Por ejemplo, en la expansión isotérmica (proceso isotérmico) de un gas, considerando el proceso como reversible, todo el calor absorbido del medio se transforma en trabajo y Q=W. Pero en la práctica real el trabajo es menor ya que hay pérdidas por rozamientos, por lo tanto, los procesos son irreversibles.
Para llevar al sistema, de nuevo, a su estado original hay que aplicarle un trabajo mayor que el producido por el gas, dando como resultado una transferencia de calor hacia el entorno, con un aumento de la entropía global.
Como los procesos reales son siempre irreversibles, siempre aumentará la entropía. Así como "la energía no puede crearse ni destruirse", la entropía puede crearse pero no destruirse. Podemos decir entonces que "como el Universo es un sistema aislado, su entropía crece constantemente con el tiempo". Esto marca un sentido a la evolución del mundo físico, que llamamos "Principio de evolución".
Cuando la entropía sea máxima en el universo, esto es, exista un equilibrio entre todas las temperaturas y presiones, llegará la muerte térmica del Universo (enunciado por Clausius). Toda la energía se encontrará en forma de calor y no podrán darse transformaciones energéticas.
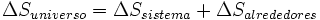
No hay comentarios:
Publicar un comentario